En esta ocasión emplearemos el tiempo en iniciar una toma de contacto con los materiales metálicos.
Dentro de esta entrada trataremos:
·Tipos de enlaces químicos.
·Enlaces metálicos.
·Metalografía (dentro de este apartado trataremos la estructura microscópica de los metales).
·Materiales metálicos.
-Clasificación por densidad e importancia industrial
-El acero
- El aluminio
Tipos de enlaces químicos
·¿En que consiste un enlace químico?
Consiste en la fuerza de unión de dos o más átomos iguales o distintos con el fin de alcanzar una estabilidad. Dichos enlaces se producen por por el movimiento de los electrones de los átomos. Los electrones que forman las uniones se les denomina electrones de Valencia y son los de último nivel energético.
 |
| Electrones de Valencia |
-Enlace ionico:
Se forma por el intercambio y ganancia de electrones entre un metal que cede electrones y un no metal que los acepta. Los átomos que forman este enlace, cumplen que:
El átomo menos electronegativo tiende a ceder los electrones, mientras que el mas electronegativo tiende a captarlos.
De esta manera ambos adquieren la configuración electrónica del gas noble mas próximo y se mantiene la neutralidad eléctrica.
 |
| Enlace iónico |
-Características de los enlaces ionicos:
-Altos puntos de fusión y ebullición: los iones son sólidos y cristalinos a temperatura ambiente, pero a temperaturas elevadas adquieren la energía necesaria para abandonar el cristal y acabar fundiéndose. Los puntos de fusión y ebullición son mayores cuanto mayor es la energía reticular (es la energía que se obtendría de la formación de un compuesto ionico a partir de sus iones gaseosos).
-Dureza:debido a la fortaleza de sus enlaces.
-Fragilidad: un pequeño desplazamiento de una capa de cristal enfrenta iones de igual carga, estos se repelen y se produce la ruptura.
-Conductividad eléctrica: estos compuestos no conducen la electricidad en estado solido, puesto que los electrones se encuentran fijos en los iones.En cambio los iones poseen la suficiente libertad de movimiento como para desplazarse dentro de un campo eléctrico, atraídos por la carga del polo opuesto de un generador en estado líquido (compuesto disuelto o fundido). Esto se debe a que esta conducción no se realiza por electrones, sino por iones.
Recibe el nombre de conducción eléctrica y las sustancias ionicas disueltas o fundidas se denominan electrolitos o conductores de segunda clase.
-Solubilidad: se disuelven bien en disolventes polares como el agua, pero no disolventes apolares como el benceno.
Esto se debe a que cada ion atrae al polo de carga opuesta al disolvente e interacciona desprendiéndose energía. Esta energía desprendida recibe el nombre de energía de solvatación.
La solubilidad es mayor cuanto menor sea la energía reticular.
·Enlace covalente:
Se produce al compartir dos electrones entre dos átomos no metálicos, uno procedente de cada átomo. Los electrones compartidos son comunes a los dos átomos, por lo que se mantienen unidos los átomos adquiriendo la estructura electrónica de gas noble.
Un ejemplo de estos son las moléculas, pequeños grupos de átomos unidos entre sí por enlaces covalentes.
 |
| Enlace covalente |
Se denomina covalencia al número de enlaces covalentes que el átomo forma.
En cuanto a las características de los enlaces covalentes, será necesario diferenciar dos tipos ya que las propiedades de estas sustancias están relacionadas con su estructura, por lo que no tendrán las mismas propiedades las sustancias moleculares que las sustancias cristalinas.
·Características de los enlaces covalentes en sustancias moleculares:
-Bajos puntos de fusión y ebullición: debido a que las fuerzas que mantienen unidas las moléculas son débiles. Contra mayor sean estas fuerzas mayor mayor será el punto de fusión y ebullición.
-No son conductores eléctricos.
-Se disuelven en disolventes apolares.
·Características de los enlaces covalentes en cristales atómicos:
-Tienen puntos de fusión y ebullición muy altos, debido a la fortaleza de sus enlaces.
-Son duros pero frágiles, ya que los átomos tienen una orientación rígida.
-No son solubles.
Estas propiedades son comunes a los cristales atómicos, exceptuando el diamante y el grafito. El diamante no es conductor de la electricidad, ya que sus electrones están localizados. En cambio el grafito conduce en la dirección de las láminas por tener cada átomo un electrón deslocalizado, pero no lo hace entre lámina y lámina.
El diamante además, refleja las radiaciones, por lo que es incoloro y transparente, mientras que el grafito es negro y absorbe todas las radiaciones.
·Enlace metálico:
Consiste en la unión de dos o más elementos metálicos. Los metales se caracterizan por tener unas propiedades comunes.
-Características de los enlaces metálicos:
-Suelen ser sólidos a temperatura ambiente, exceptuando el mercurio.
-Poseen una gran conductividad térmica y eléctrica.
-Son menos electronegativos, por lo que presentan un brillo metálico.
-Son dúctiles y maleables. Sus electrones pueden moverse sin producir roturas.
-Pueden emitir electrones cuándo reciben energía en forma de calor.
-Poseen efecto fotoeléctrico, es decir, pierden electrones de sus últimas capas cuándo reciben radiación electromagnética (luz).
Enlaces metálicos
·Teoría del gas electrónico:
En el año 1902 se desarrolla esta teoría con el fin de explicar las propiedades físicas de los metales.
El cristal formado por átomos en forma de iones positivos y los electrones de valencia moviéndose libremente por los intersticios que dejan los cationes.
Los electrones de valencia son los encargados de evitar que los iones positivos se repelan. El límite del gas de electrones es la superficie del cristal.
Según esta teoría los electrones no pertenecen a un único átomo, si a todo el conjunto metálico, lo que explica las propiedades de dichos metales.
La conductividad eléctrica se explica de forma cualitativa, ya que en muchos casos debería ser mayor de lo que es, a consecuencia de la gran movilidad de los electrones que muestra esta teoría.
·Teoría de bandas:
Aplicando la mecánica cuántica con el fin de explicar la naturaleza de los enlaces metálicos, apareció la teoría de bandas.
En una porción de metal existen un gran número de átomos iguales, con orbitales de igual energía.
En el año 1902 se desarrolla esta teoría con el fin de explicar las propiedades físicas de los metales.
El cristal formado por átomos en forma de iones positivos y los electrones de valencia moviéndose libremente por los intersticios que dejan los cationes.
Los electrones de valencia son los encargados de evitar que los iones positivos se repelan. El límite del gas de electrones es la superficie del cristal.
Según esta teoría los electrones no pertenecen a un único átomo, si a todo el conjunto metálico, lo que explica las propiedades de dichos metales.
La conductividad eléctrica se explica de forma cualitativa, ya que en muchos casos debería ser mayor de lo que es, a consecuencia de la gran movilidad de los electrones que muestra esta teoría.
·Teoría de bandas:
Aplicando la mecánica cuántica con el fin de explicar la naturaleza de los enlaces metálicos, apareció la teoría de bandas.
En una porción de metal existen un gran número de átomos iguales, con orbitales de igual energía.
Estos orbitales interaccionan, originando nuevos orbitales conocidos como orbitales moleculares. Estos pertenecen a todas las moléculas en número igual al de los orbitales combinados. La energía entre estos orbitales moleculares que abarcan todo el fragmento metálico es muy próxima, por lo que es prácticamente continua.
Una banda de energía consiste en un grupo de orbitales de energía muy próxima.
Los electrones se sitúan ocupando los orbitales de menos a mayor energía y de dos en dos con espines anti paralelos.
-Existen dos bandas de energía:
·Banda de Valencia: es la última banda ocupada o semi ocupada. Se forma a partir de los orbitales del último nivel de energía que este ocupado.
·Banda de conducción: es la banda de menor energía que se encuentra ocupada.
Solo conducen aquellos electrones que se encuentren en una banda parcialmente ocupada, ya que al aplicar un campo eléctrico, se pueden desplazar por los orbitales vacíos adyacentes, produciendo un flujo de electrones en una banda llena en la que los orbitales están ocupados. Los electrones pueden intercambiar sus lugares pero no desplazarse.
·Características de los enlaces metálicos:
Las propiedades de los metales depende entre otras cosas a la energía del enlace metálico. Sus propiedades principales son:
-Conductividad eléctrica y térmica: se debe a la existencia de electrones libres en las bandas de energía.
-Puntos de fusión y ebullición: los puntos de ebullición y fusión más bajos corresponde a los alcalinos, y va aumentando hasta llegar a los elementos centrales de la serie de transición. A partir de esto elementos centrales disminuye a medida que se avanza por el sistema periódico.
En cuanto a sus propiedades mecánicas:
-Densidad: los metales alcalinos son los menos densos mientras que los metales del centro de las series de transmisión poseen densidades más altas debido a que el volumen atómico es menor.
-Dureza: su valor está relacionado con la energía de enlace, por lo que la variación será similar a la de la densidad.
-Ductilidad y maleabilidad: los metales se pueden estirar en hilos (son dúctiles) se puede obtener de ellos láminas muy finas (son maleables). Esto se debe a que los átomos están sometido a fuerzas iguales en todas las direcciones y pueden sufrir desplazamientos.
En cuánto a sus propiedades ópticas:
Los metales tienen un alto poder de reflexión, por lo que tienen un brillo metálico. la mayoría de los metales reflejan todas las longitudes de ondas que inciden sobre ellos, por lo que adquieren un color plateado.
Existen dos excepciones, el oro y el cobre, que reflejan las longitudes de ondas correspondientes a color amarillo y rojo respectivamente.
-Efecto foto-eléctrico y termo-ionico:
Los metales pueden emitir electrones por excitación luminosa o térmica ya que la energía suministrada por cualquiera de estas fuentes es suficiente para que los electrones puedan vencer el campo eléctrico creado por los cationes de la red cristalina y escapar de su atracción.
·¿Qué es?
La metalografía es la ciencia que estudia las propiedades que constituyen a un metal o a una aleación, relacionándolas con las propiedades físicas, químicas y mecánicas.
Para llevar acabo estos estudios es necesario obtener muestras representativas que no hayan sufrido alteraciones.
·Estructura microscópica de los metales:
Los metales tienen densidades relativamente altas comparados con otros elementos no metálicos, por lo que los átomos han de estar muy próximos unos a otros, formando redes compactas coordinadas, que se corresponden con el máximo aprovechamiento de espacio posible, como consecuencia de la unión de átomos iguales.
Mediante técnicas de difracción de rayos X, podemos observar que los metales se pueden cristalizar en las siguientes estructuras:
-Estructura cubica centrada en el cuerpo (BCC):
Se compone por un átomo del metal en cada vértice del cubo y otro ´tomo en el centro.
Cada uno de los átomo que componen esta estructura está rodeado de otros ocho átomos.
Los metales más comunes que emplean esta composición son:
-Tungsteno.
-Cromo.
-Vanadio.
-Estructura cúbica centrada en las caras (FCC):
Está constituida de forma similar a la BCC, componiéndose por un átomo en cada vértice pero, en lugar de un átomo en el centro, posee un átomo en cada cara del cubo.
Los metales más comunes que emplean esta composición son:
-Oro.
-Plata.
-Cobre.
-Cromo.
-Estructura hexagonal compacta (HCP):
Esta estructura se caracteriza principalmente por no disponer de un cubo, sino que tiene un prisma hexagonal en el que en cada vértice se localiza un átomo, otro en cada base y otros tres en el centro de dicho prisma. Cada uno de los átomos de esta estructura está rodeado por otros doce átomos.
Los metales más comunes que emplean esta composición son:
-Titanio.
-Magnesio.
-Zinc
-Cobalto.
·Proceso de cristalización:
Para poder cambiar la estructura de un metal será necesario calentarlo hasta que llegue a su punto de fusión, rompiendo con ello las uniones ya que se agruparán al azar. Al enfriar el material los átomos van perdiendo movilidad, haciendo que el metal se quede sólido.
Una vez alcanzada la temperatura de solidificación, estos grupos aislados de átomos quedan ya enlazados como el cristal elemental, adquiriendo una estructura rígida de orientación. Los átomos vecinos una vez perdida la energía térmica necesaria, se van uniendo al cristal elemental formado, formando nuevos cristales elementales unidos y comienzan a formar redes cristalinas en crecimiento dentro de la masa liquida. Estos cristales en crecimiento, cuando alcanzan cierto tamaño se convierten en núcleos de cristalización, y a su alrededor comienza a tejerse la red cristalina, a medida que más y más átomos van perdiendo energía con el enfriamiento.
Estos cristales pueden comenzar a crecer en múltiples lugares simultáneamente y a expandirse en diferentes direcciones.
·Tamaño del grano:
Una vez se cristalice el material, se formaran granos.
Los granos son agrupaciones de material que al agruparse entre ellos forman la pieza.
En una misma pieza, el tamaño de los granos que la componen puede variar. Esto se debe al tratamiento que haya sufrido dicha pieza, que conforma unos granos u otros.
Por ejemplo, al someter una pieza a elevadas temperaturas, el tamaño de los granos va aumentando.
Un tamaño de grano pequeño dota a la pieza de mayor resistencia a la tracción, mayor dureza y se distorsionan menos durante el temple.
Los granos gruesos aumentan la dureza.
Los granos más utilizados son los granos finos.
Existen diversos método de clasificación de granos pero el más empleado es el que determina el tamaño de grano contando los granos de una pulgada cuadrada bajo la visión de un microscopio.
·Importancia Industrial de los materiales metálicos:
El metal es un material que se extrae de entre las rocas mediante un proceso de depuración. El metal puro no se suele emplear debido a su alto coste, por lo que generalmente se usan aleaciones de este.
En el sector de la automoción es muy importante, ya que casi todo de lo que están compuestos los vehículos esta compuesto por metal, el chasis, la carrocería, circuitos eléctricos, incluso la mayoría de las herramientas que se emplean para la reparación de vehículos.
·Clasificación de los metales por su densidad:
La densidad es la cantidad de masa de una sustancia en un volumen determina.
En la imagen siguiente podéis ver la densidad de algunos metales.
·Acero:
El acero es una aleación de carbono y hierro. El porcentaje de hierro no supera el 98% porque si se sobrepasa esa cantidad el metal se volvería muy duro, por lo que suele poseer más de un 99.5% de hierro. Además de estos elementos, suelen añadirse elemento como el manganeso, el cromo o el molibdeno para conseguir el acero con las características necesarias.
-Características del acero:
-Su densidad es de 7850 kg/cm3.
-Su punto de fusión ronda los 1500 grados, dependiendo de la aleación.
-Es resistente a los impactos y maleable.
-Es buen conductor tanto de la electricidad como del calor.
El mayor problema que puede tener el acero es el oxido, ya que es fácil que este aparezca en él. Para prevenir esto es aconsejable aislarlo del aire y de la humedad mediante tratamientos superficiales.
El acero sufre cambios de calor a medida que se va calentando. A continuación se mostrará una lista en la que se reflejan los diferentes colores que puede adoptar dependiendo de la temperatura:
-200°C: sin color.
-220°C: amarillo claro.
-230°C: amarillo.
-240°C: amarillo oscuro.
-255°C: naranja amarillento.
-265°C: naranja rojizo.
-275°C: rojo púrpura.
-285°C: violeta.
-295°C: azul oscuro.
-310°C: azul claro.
-325°C: gris.
-330°C: se pierde nuevamente el color.
-700°C rojo oscuro.
-800°C rojo cereza.
-900°C rojo claro.
-1000°C salmón.
-1100°C naranja.
-1200°C amarillo limón.
-1300°C blanco.
-Tipos de aceros:
-Aceros estructurales: estos aceros suelen utilizarse para conformar piezas de maquinas, estructuras de automóviles, edificios, barcos, etc. El contenido de la aleación varía entre el 0.25 y el 6%.
-Aceros para herramientas: son aceros de alta calidad que se emplean para conformar herramientas.
-Aceros especiales: aceros inoxidables o con un contenido de cromo mayor al 12%. Estos aceros presentan una gran dureza y una alta resistencia a las temperaturas elevadas y a la corrosión. Se emplean en engranajes, turbinas, ejes, etc.
·Aluminio:
El aluminio es un material que se encuentra mezclado con otros en la naturaleza, generalmente en rocas, arcillas, etc. La mayor extracción de aluminio se obtiene del mineral bauxita.
-Características del aluminio:
-Es ligero, dúctil y maleable.
-Su punto de fusión se sitúa a 660°C.
-Es buen conductor tanto eléctrico como térmico.
-Al oxidarse crea una capa de oxido de aluminio que lo protege, por lo que se puede decir que es resistente a la corrosión.
Una banda de energía consiste en un grupo de orbitales de energía muy próxima.
Los electrones se sitúan ocupando los orbitales de menos a mayor energía y de dos en dos con espines anti paralelos.
-Existen dos bandas de energía:
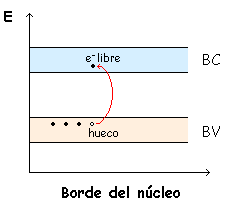 |
| Banda de Valencia (BV) y Banda de Conducción (BC) |
·Banda de conducción: es la banda de menor energía que se encuentra ocupada.
Solo conducen aquellos electrones que se encuentren en una banda parcialmente ocupada, ya que al aplicar un campo eléctrico, se pueden desplazar por los orbitales vacíos adyacentes, produciendo un flujo de electrones en una banda llena en la que los orbitales están ocupados. Los electrones pueden intercambiar sus lugares pero no desplazarse.
·Características de los enlaces metálicos:
Las propiedades de los metales depende entre otras cosas a la energía del enlace metálico. Sus propiedades principales son:
-Conductividad eléctrica y térmica: se debe a la existencia de electrones libres en las bandas de energía.
-Puntos de fusión y ebullición: los puntos de ebullición y fusión más bajos corresponde a los alcalinos, y va aumentando hasta llegar a los elementos centrales de la serie de transición. A partir de esto elementos centrales disminuye a medida que se avanza por el sistema periódico.
En cuanto a sus propiedades mecánicas:
-Densidad: los metales alcalinos son los menos densos mientras que los metales del centro de las series de transmisión poseen densidades más altas debido a que el volumen atómico es menor.
-Dureza: su valor está relacionado con la energía de enlace, por lo que la variación será similar a la de la densidad.
-Ductilidad y maleabilidad: los metales se pueden estirar en hilos (son dúctiles) se puede obtener de ellos láminas muy finas (son maleables). Esto se debe a que los átomos están sometido a fuerzas iguales en todas las direcciones y pueden sufrir desplazamientos.
En cuánto a sus propiedades ópticas:
Los metales tienen un alto poder de reflexión, por lo que tienen un brillo metálico. la mayoría de los metales reflejan todas las longitudes de ondas que inciden sobre ellos, por lo que adquieren un color plateado.
Existen dos excepciones, el oro y el cobre, que reflejan las longitudes de ondas correspondientes a color amarillo y rojo respectivamente.
-Efecto foto-eléctrico y termo-ionico:
Los metales pueden emitir electrones por excitación luminosa o térmica ya que la energía suministrada por cualquiera de estas fuentes es suficiente para que los electrones puedan vencer el campo eléctrico creado por los cationes de la red cristalina y escapar de su atracción.
Metalografía
·¿Qué es?
La metalografía es la ciencia que estudia las propiedades que constituyen a un metal o a una aleación, relacionándolas con las propiedades físicas, químicas y mecánicas.
Para llevar acabo estos estudios es necesario obtener muestras representativas que no hayan sufrido alteraciones.
·Estructura microscópica de los metales:
Los metales tienen densidades relativamente altas comparados con otros elementos no metálicos, por lo que los átomos han de estar muy próximos unos a otros, formando redes compactas coordinadas, que se corresponden con el máximo aprovechamiento de espacio posible, como consecuencia de la unión de átomos iguales.
Mediante técnicas de difracción de rayos X, podemos observar que los metales se pueden cristalizar en las siguientes estructuras:
-Estructura cubica centrada en el cuerpo (BCC):
Se compone por un átomo del metal en cada vértice del cubo y otro ´tomo en el centro.
Cada uno de los átomo que componen esta estructura está rodeado de otros ocho átomos.
 |
| Estructura BCC |
-Tungsteno.
-Cromo.
-Vanadio.
-Estructura cúbica centrada en las caras (FCC):
Está constituida de forma similar a la BCC, componiéndose por un átomo en cada vértice pero, en lugar de un átomo en el centro, posee un átomo en cada cara del cubo.
 |
| Estructura FCC |
-Oro.
-Plata.
-Cobre.
-Cromo.
-Estructura hexagonal compacta (HCP):
Esta estructura se caracteriza principalmente por no disponer de un cubo, sino que tiene un prisma hexagonal en el que en cada vértice se localiza un átomo, otro en cada base y otros tres en el centro de dicho prisma. Cada uno de los átomos de esta estructura está rodeado por otros doce átomos.
 |
| Estructura HCP |
-Titanio.
-Magnesio.
-Zinc
-Cobalto.
·Proceso de cristalización:
Para poder cambiar la estructura de un metal será necesario calentarlo hasta que llegue a su punto de fusión, rompiendo con ello las uniones ya que se agruparán al azar. Al enfriar el material los átomos van perdiendo movilidad, haciendo que el metal se quede sólido.
Una vez alcanzada la temperatura de solidificación, estos grupos aislados de átomos quedan ya enlazados como el cristal elemental, adquiriendo una estructura rígida de orientación. Los átomos vecinos una vez perdida la energía térmica necesaria, se van uniendo al cristal elemental formado, formando nuevos cristales elementales unidos y comienzan a formar redes cristalinas en crecimiento dentro de la masa liquida. Estos cristales en crecimiento, cuando alcanzan cierto tamaño se convierten en núcleos de cristalización, y a su alrededor comienza a tejerse la red cristalina, a medida que más y más átomos van perdiendo energía con el enfriamiento.
Estos cristales pueden comenzar a crecer en múltiples lugares simultáneamente y a expandirse en diferentes direcciones.
·Tamaño del grano:
Una vez se cristalice el material, se formaran granos.
Los granos son agrupaciones de material que al agruparse entre ellos forman la pieza.
En una misma pieza, el tamaño de los granos que la componen puede variar. Esto se debe al tratamiento que haya sufrido dicha pieza, que conforma unos granos u otros.
Por ejemplo, al someter una pieza a elevadas temperaturas, el tamaño de los granos va aumentando.
Un tamaño de grano pequeño dota a la pieza de mayor resistencia a la tracción, mayor dureza y se distorsionan menos durante el temple.
Los granos gruesos aumentan la dureza.
Los granos más utilizados son los granos finos.
Existen diversos método de clasificación de granos pero el más empleado es el que determina el tamaño de grano contando los granos de una pulgada cuadrada bajo la visión de un microscopio.
Materiales metálicos
El metal es un material que se extrae de entre las rocas mediante un proceso de depuración. El metal puro no se suele emplear debido a su alto coste, por lo que generalmente se usan aleaciones de este.
En el sector de la automoción es muy importante, ya que casi todo de lo que están compuestos los vehículos esta compuesto por metal, el chasis, la carrocería, circuitos eléctricos, incluso la mayoría de las herramientas que se emplean para la reparación de vehículos.
·Clasificación de los metales por su densidad:
La densidad es la cantidad de masa de una sustancia en un volumen determina.
En la imagen siguiente podéis ver la densidad de algunos metales.
 |
| Densidad de algunos metales |
El acero es una aleación de carbono y hierro. El porcentaje de hierro no supera el 98% porque si se sobrepasa esa cantidad el metal se volvería muy duro, por lo que suele poseer más de un 99.5% de hierro. Además de estos elementos, suelen añadirse elemento como el manganeso, el cromo o el molibdeno para conseguir el acero con las características necesarias.
-Características del acero:
-Su densidad es de 7850 kg/cm3.
-Su punto de fusión ronda los 1500 grados, dependiendo de la aleación.
-Es resistente a los impactos y maleable.
-Es buen conductor tanto de la electricidad como del calor.
El mayor problema que puede tener el acero es el oxido, ya que es fácil que este aparezca en él. Para prevenir esto es aconsejable aislarlo del aire y de la humedad mediante tratamientos superficiales.
El acero sufre cambios de calor a medida que se va calentando. A continuación se mostrará una lista en la que se reflejan los diferentes colores que puede adoptar dependiendo de la temperatura:
-200°C: sin color.
-220°C: amarillo claro.
-230°C: amarillo.
-240°C: amarillo oscuro.
-255°C: naranja amarillento.
-265°C: naranja rojizo.
-275°C: rojo púrpura.
-285°C: violeta.
-295°C: azul oscuro.
-310°C: azul claro.
-325°C: gris.
-330°C: se pierde nuevamente el color.
(Si seguimos aumentando la temperatura el acero comenzará a variar su brillo)
-650°C comienza el rojo oscuro.-700°C rojo oscuro.
-800°C rojo cereza.
-900°C rojo claro.
-1000°C salmón.
-1100°C naranja.
-1200°C amarillo limón.
-1300°C blanco.
-Tipos de aceros:
-Aceros estructurales: estos aceros suelen utilizarse para conformar piezas de maquinas, estructuras de automóviles, edificios, barcos, etc. El contenido de la aleación varía entre el 0.25 y el 6%.
-Aceros para herramientas: son aceros de alta calidad que se emplean para conformar herramientas.
-Aceros especiales: aceros inoxidables o con un contenido de cromo mayor al 12%. Estos aceros presentan una gran dureza y una alta resistencia a las temperaturas elevadas y a la corrosión. Se emplean en engranajes, turbinas, ejes, etc.
·Aluminio:
El aluminio es un material que se encuentra mezclado con otros en la naturaleza, generalmente en rocas, arcillas, etc. La mayor extracción de aluminio se obtiene del mineral bauxita.
-Características del aluminio:
-Es ligero, dúctil y maleable.
-Su punto de fusión se sitúa a 660°C.
-Es buen conductor tanto eléctrico como térmico.
-Al oxidarse crea una capa de oxido de aluminio que lo protege, por lo que se puede decir que es resistente a la corrosión.
``Y esto es todo por hoy amigos, espero haberos sido de utilidad. Muchísimas gracias por utilizar este blog como fuente de conocimiento, así que abonense y recomienden esta página a sus amigos y sobre todo a sus amigas jeje. Un saludo y hasta la próxima entrada´´

No hay comentarios:
Publicar un comentario